来源:bat365官网登录 发布时间:2023-02-02 浏览次数:106
近日,华南农业大学、岭南现代农业科学与技术广东省实验室与美国疾病预防控制中心等合作,研究解析了重要腹泻病原—隐孢子虫中高传播力亚型的产生和演化机制。相关研究发表于Cell Host & Microbe(链接:https://doi.org/10.1016/j.chom.2022.11.013),并被作为精选文章(Featured content)重点推荐。同时,领域知名学者墨尔本大学Aaron R. Jext教授和东英吉利大学Kevin M. Tyler教授对该成果高度评价,相关推介文章同刊同期发表(链接:https://doi.org/10.1016/j.chom.2022.12.012)。
人隐孢子虫(Cryptosporidium hominis)是全球范围内分布广泛的主要腹泻病原之一。近年来,其流行率呈快速增长趋势,并出现了一个高传播力亚型IfA12G1R5,在多个国家引起大规模疾病暴发。然而,导致该高传播力亚型产生的遗传机制尚不清楚。
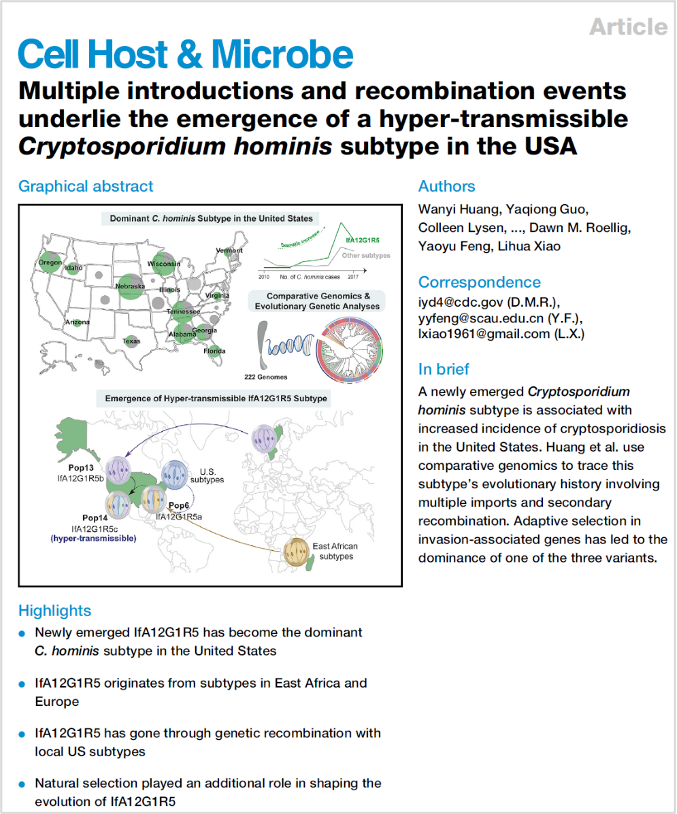
在该项工作中,研究人员对不同国家和地区的127个分离株进行全基因组测序,并结合公共数据库中95个全基因组数据,重点解析了人隐孢子虫的群体结构、分子进化过程和高传播力亚型的形成机制。研究发现,高传播力亚型IfA12G1R5为目前人隐孢子虫的优势亚型,分布于人隐孢子虫14个亚群体中的3个亚群体中,意味着该亚型有多个来源。
在IfA12G1R5的三个变异株中,IfA12G1R5a起源于非洲,并在美洲与当地隐孢子虫群体发生重组;IfA12G1R5b起源于欧洲,与欧洲流行的IbA10G2亚型存在基因交流;而最近广泛流行的高传播力IfA12G1R5c变异株是由IfA12G1R5a和IfA12G1R5b二次重组而形成。除外源输入和基因重组外,入侵相关基因序列(如mucin蛋白家族等)的适应性选择也是高传播力亚型变异株涌现的重要决定因素。
Aaron R. Jext教授和Kevin M. Tyler教授在其推介文章(American variants of Cryptosporidium hominis: Over-sexed and over here?)中指出,该研究对隐孢子虫群体遗传学研究具有重要推进作用,不仅填补了我们对人隐孢子虫全球群体结构认知的空白,而且揭示了不同地区和不同亚型的人隐孢子虫之间的群体结构差异,以及遗传重组对人隐孢子虫世系间和世系内遗传关系的影响。此外,该研究也进一步说明了mucin蛋白对隐孢子虫感染性、宿主适应性以及毒力的重要作用,对新治疗方法的开发具有重要意义。
据了解,相关研究团队开展隐孢子虫分子流行病学研究近30年。近年来,团队突破了从临床样本直接开展病原全基因组分析的技术瓶颈,完成了近1000个分离株的测序和比较基因组学分析,系统揭示了隐孢子虫宿主适应性和高毒力形成的遗传机制。该研究揭示的高传播力亚型的产生机制,是继近期有关隐孢子虫跨种传播力的遗传基础研究成果后的又一全新突破。
上述研究得到广东省基础与应用基础研究重大项目、国家自然科学基金、“111计划”和广东省普通高校创新团队项目的资助。
文图/bat365官网登录